 服务热线:022-66387942
服务热线:022-66387942
 服务热线:022-66387942
服务热线:022-66387942
 更新时间:2025-12-16
更新时间:2025-12-16 点击次数:241
点击次数:241
一、蛋白在浓缩时出现了沉淀,如何改进?
蛋白如果浓缩过快或者过度浓缩都有可能引起蛋白沉淀。建议蛋白浓缩后的最终浓度不超过20mg/ml。对于对浓缩速度敏感而容易沉淀的蛋白,建议的改进方法是:
1)离心力降为推荐离心力的30%-50%
2)改用截留分子量更大的超滤管(如原本选用10k,此时可以选择30k)
3)在浓缩过程中取出超滤管,用枪头反复吹吸几次后再继续浓缩
4)体积较大的样品可考虑选用搅拌式超滤杯,减少沉淀的发生。
二、Amicon® Ultra超滤管可以用酒精消毒灭菌么?
Amicon® Ultra与70%乙醇是兼容的,但是对灭菌处理的具体方法没有做相关的测试,所以无法提供更进一步的参考信息。建议采用Ultrafree无菌离心管对浓缩后的样品进行过滤除菌。
三、Amicon® Ultra超滤装置是否可以用于高压灭菌?
Amicon® Ultra都是采用热封设计,不可以用高压高温灭菌。
四、怀疑浓缩过程中目的蛋白和超滤膜之间可能存在非特异性吸附,如何改善?
Amicon® Ultra超滤管使用的是再生纤维素膜,这种材质是蛋白吸附zui低的超滤膜。但是对于一些疏水性蛋白或非极性蛋白,它们和膜的非特异吸附可能会增强。对于这种情况,可以尝试在实验前对超滤管进行封闭处理,也可以尝试换成Amicon® Ultra 0.5或2来进行实验,通过减小膜面积来降低非特异性吸附。
五、有时候用超滤离心管连水都离不下来,可能是什么原因?
Amicon® Ultra超滤膜中含有微量甘油。如果出现这种情况,请先用0.1 N NaOH清洗再离心。最后用缓冲液或Milli-Q®水再次清洗后甩干。清洗后的滤膜应立即使用,如暂时不用,请保持润湿状态,避免重新干燥。
六、如果要用超滤的方法分离两种蛋白,那么这两个蛋白的大小需要相差多少?
按照经验,建议两个蛋白的分子量要相差一个数量级(10倍)。
七、说明书中推荐在室温下进行离心,考虑到蛋白的稳定性,是否可以在4℃进行离心?
可以,但是低温会增加蛋白样品的粘性,导致流速减慢,建议可将离心时间延长到原来的1.5倍。
八、浓缩后发现浓缩液中没有目的蛋白,可能的原因有哪些?
首先,Amicon® Ultra超滤管的蛋白zui低起始浓度为25ug/ml。请确保样本的起始浓度大于这个浓度。其次,如果问题仍然出现,请不要丢弃样本滤过液以便用于分析可能的原因:
1)如果目的样本在滤过液中,那么请排查:
a) 是否选择了合适截留分子量的超滤管(目的蛋白分子量的1/2或者1/3)?
b)使用的离心力是否是在限定范围内?如果使用的是rpm,请换算成相应的g离心力,具体换算方法请垂询。
c)离心机最近是否有校准过?
d)是否shou次尝试这个蛋白?如果能确保用同样的超滤管对其它蛋白成功操作的话,那么有可能是这个目的蛋白的原因。有时蛋白会因其本身的一些特性(构象差异)而影响浓缩效果,建议选用更小截留分子量的超滤管(如原本选用30k,此时可以选择10k)
2)如果目的样本也不在滤过液中,那么:
a)蛋白样本起始浓度是否大于25ug/mL?
b)用来确定样本浓度的方法是什么?是否可信?
c)目的蛋白是不是沉淀了?如果是,具体解决方法请参考上面的关于蛋白沉淀问题的解释。
九、产品订购信息:
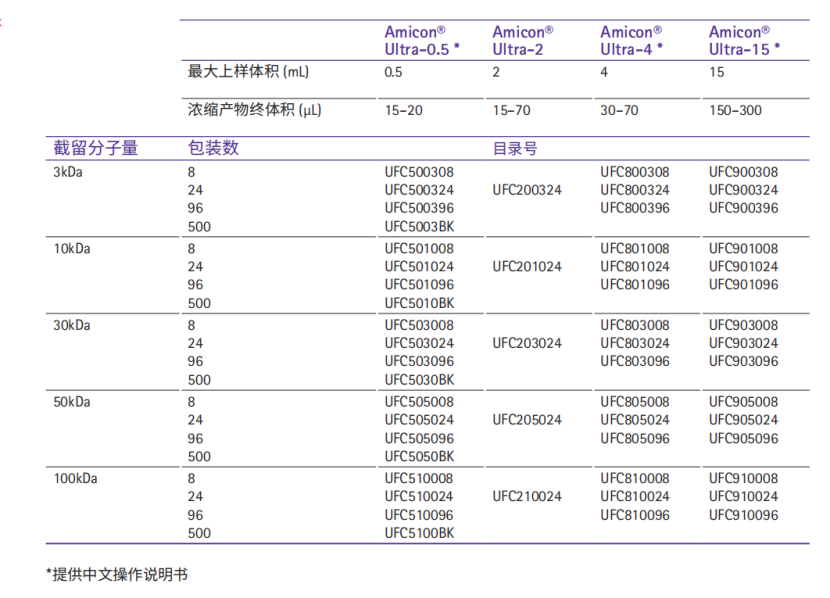
密理博代理——天津益元利康生物科技有限公司
天津益元利康生物科技有限公司:
益元利康有限公司是一家专注于生命科学实验室快速消耗品为主营方向的生命科技企业,提供完整的产品和服务体系,为广大的科研用户提供实验室一站式服务。益元利康已成为多家生物品牌的代理商,如ALZET、MedKoo、EZB、WaKo、Zymo research、Qiagen等,为用户提供完善的产品、专业的咨询,助力推动中国生命科学研究快速发展。
